添付文書用XML解析 6. その他の副作用
投稿日:2024.10.15
更新日:2024.10.15
添付文書用XML解析 6
- ■今後の予定■
…以降未定
副作用の表
今回はその他の副作用の表についての説明です。
以前にもその他の副作用について触れた記事を公開しておりますが、改めて解説していきたいと思います。
(構造や用途は変わりませんが、当時は要素名などが未定でした。)
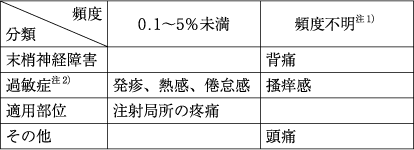
今回は下記の様な表を例に解説していきたいと思います。
SGMLの場合
SGMLでのその他の副作用の表記は下記のような記述でした。
<otheradverse> <variablelabel>その他の副作用</variablelabel> <serialno onoff="off"><variablelabel>順序番号</variablelabel>0</serialno> <detail><variablelabel>詳細</variablelabel>次のような副作用が認められた場合には、症状に応じて適切な処置を行うこと。</detail> <serialno><variablelabel>順序番号</variablelabel>1</serialno> <item><variablelabel>種類</variablelabel><chr><bold>末梢神経障害</bold></chr></item> <frequency><variablelabel>頻度</variablelabel>頻度不明<chem><sup>注1)</sup></chem></frequency> <detail><variablelabel>説明</variablelabel>背痛</detail> <serialno><variablelabel>順序番号</variablelabel>2</serialno> <item><variablelabel>種類</variablelabel><chr><bold>過敏症<sup>注2)</sup></bold></chr></item> <frequency><variablelabel>頻度</variablelabel>0.1~5%未満</frequency> <detail><variablelabel>説明</variablelabel>発疹、熱感、倦怠感</detail> <serialno><variablelabel>順序番号</variablelabel>3</serialno> <item><variablelabel>種類</variablelabel><chr><bold>感染症</bold></chr></item> <frequency><variablelabel>頻度</variablelabel>頻度不明<sup>注1)</sup></frequency> <detail><variablelabel>説明</variablelabel>搔痒感</detail> </otheradverse>
4-7行目がセルの1つを指しています。
どの種類の、どの症状が、どのぐらいの頻度で発生するかを読み取ることは可能でしたが、文字の羅列の域を出ない為、表として表示することが困難でした。
そのためPMDAでもセルの内容毎に分けて記述されており、添付文書との違いが発生していました。
XMLの場合
新記載要領のXMLでは下記の様な表記となり、表として再構成できる形式となりました。
<!-- その他の副作用 -->
<OtherAdverseEvent>
<OtherAdverse>
<!-- 表の幅定義 -->
<WidthDefinition totalWidth="348px">
<Col width="78.24px" />
<Col width="117.36px" />
<Col width="130.4px" />
</WidthDefinition>
<!-- その他の副作用の種類の定義 -->
<CategoryDefinition>
<Category id="Category1">
<Lang xml:lang="ja">末梢神経障害</Lang>
</Category>
<Category id="Category2">
<Lang xml:lang="ja">過敏症<Sup>注2)</Sup></Lang>
</Category>
<Category id="Category3">
<Lang xml:lang="ja"> 適用部位</Lang>
</Category>
<Category id="Category4">
<Lang xml:lang="ja"> その他</Lang>
</Category>
</CategoryDefinition>
<!-- その他の副作用の頻度の定義 -->
<FrequencyDefinition>
<Frequency id="Frequency1">
<Lang xml:lang="ja">0.1~5%未満</Lang>
</Frequency>
<Frequency id="Frequency2">
<Lang xml:lang="ja">頻度不明<Sup>注1)</Sup></Lang>
</Frequency>
</FrequencyDefinition>
<!-- その他の副作用の説明群 -->
<AdverseReactions>
<AdverseReactionDescription categoryRef="Category1" frequencyRef="Frequency2">
<Detail>
<Lang xml:lang="ja">背痛</Lang>
</Detail>
</AdverseReactionDescription>
<AdverseReactionDescription categoryRef="Category2" frequencyRef="Frequency1">
<Detail>
<Lang xml:lang="ja">発疹、熱感、倦怠感</Lang>
</Detail>
</AdverseReactionDescription>
<AdverseReactionDescription categoryRef="Category2" frequencyRef="Frequency2">
<Detail>
<Lang xml:lang="ja">搔痒感</Lang>
</Detail>
</AdverseReactionDescription>
<AdverseReactionDescription categoryRef="Category3" frequencyRef="Frequency1">
<Detail>
<Lang xml:lang="ja">注射局所の疼痛</Lang>
</Detail>
</AdverseReactionDescription>
<AdverseReactionDescription categoryRef="Category4" frequencyRef="Frequency2">
<Detail>
<Lang xml:lang="ja">頭痛</Lang>
</Detail>
</AdverseReactionDescription>
</AdverseReactions>
</OtherAdverse>
</OtherAdverseEvent>
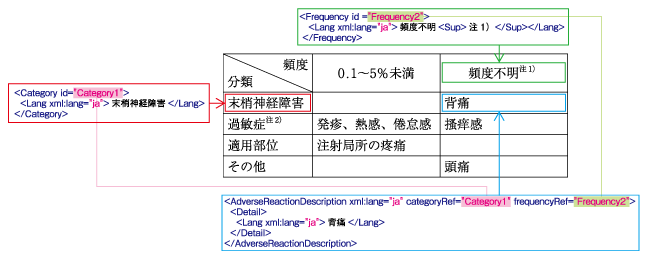
まず、その他の副作用の種類・その他の副作用の頻度・その他の副作用の説明が分けて記述されるようになりました。
その他の副作用の種類・その他の副作用の頻度にはidの割り当てが必須になっており、その他の副作用の説明が両方のidを参照することで、表上での位置関係を再現できる形式となっています。
上記ソースのマーキング部であれば下図のような関係性を持つことになります。
内容がヘッダを参照していることが伝わるでしょうか。
また、表形式での記述される箇所になるためWidthDefinition要素が用意され、列の横幅が設定可能となりました。
より添付文書に近いレイアウトを目指すことが可能となっていますね。
なおidの命名規則などはスキーマのver0.9.5時点では不明です。
今回の例では過去に配布されたデータを元に”Category1″・”Frequency1″などとしていますが、もしかしたら今後指定がされるかもしれません。
今回は過去に書いた記事と重複した内容になってしまいましたがいかがでしたでしょう?
次回はXML化に伴い最も複雑になったであろう組成・性状について解説したいと思います。