医薬品添付文書のXML【その他の副作用について】
投稿日:2017.04.27
更新日:2025.11.04
4月の14・18日に「医薬品添付文書記載要領改正に関する説明会」が開催され、新記載要領やXML化に関する説明が行われました。
これまでの説明から大きな変化は見られませんが、細かな仕様や具体例について触れられた点が多かったのではないでしょうか。
(配布資料)
新記載要領に合わせ、XML化の仕様も進められています。
「利用者がデータ活用しやすいフォーマット」と題され、今回の説明会ではその他の副作用についての例が説明されました。(配布資料49・50ページ目)
説明会では軽く触れられただけですので、 資料49ページで使用されている物と同じ医薬品(一般名:モンテルカストナトリウム)を例に、どのように活用しやすくなったかを解説したいと思います。
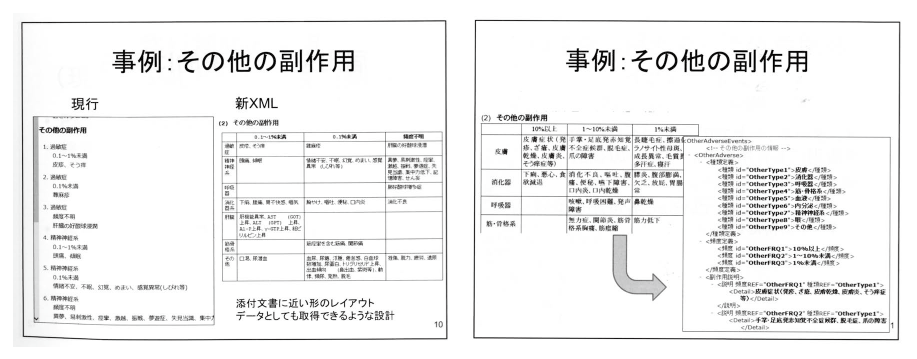
(配布資料49・50ページ)
SGML
今までのSGMLでは、その他の副作用は表形式で記載されているのではなくリストで表現されていました。
どの症状がどの頻度で発生するのか?を読み取ることは可能であり、単純に読むだけであれば十分な記述でしたが、紙の添付文書とレイアウトは大きく異なっていました。
XML
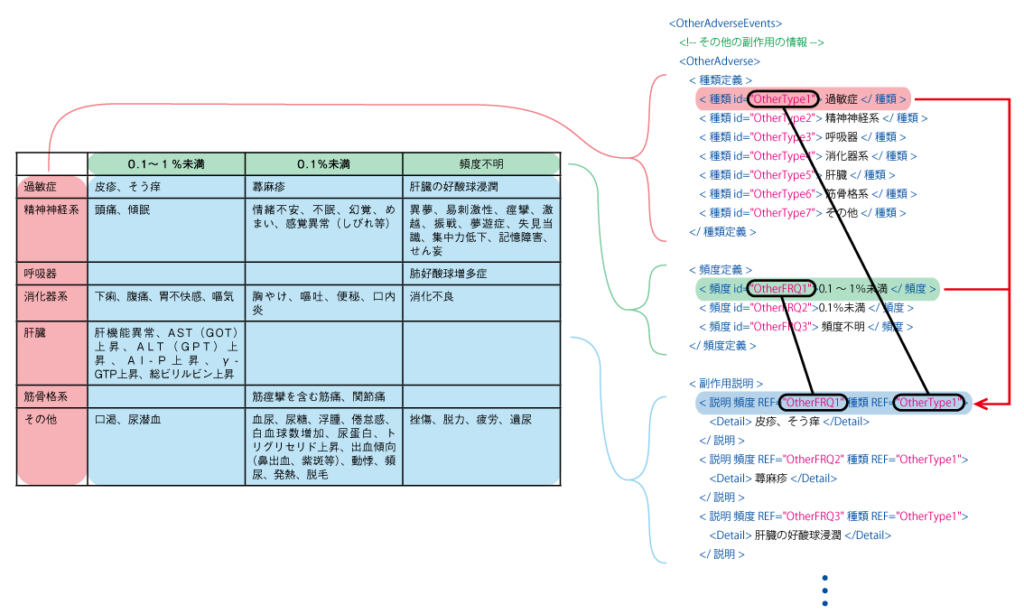
新たに定義されるXMLでは表としての構造を維持したまま、データを取得できるように設計されています。
列のヘッダ・行のヘッダ・内容を分けて記述し、それぞれを割り振ったidで紐付ける形になっています。
内容が書かれているタグに、列のヘッダと行のヘッダのidが記述されているので、何行目の何列目にどの内容が記述されているのかが明確になりました。
情報を正確に取得することができ、かつ紙の添付文書に近いレイアウトを再現することが可能となっています。
未だに詳細な仕様が発表されていないため一概には言えませんが、SGMLに比べかなり扱いやすくなりました。
データ形式もXMLになることで、利用可能な環境も増えるため、今後は活用される場面が増えることが期待されます。













