添付文書の新記載要領化、自動組版(Pix Auto)のご提案
投稿日:2023.07.26
更新日:2024.05.06
2023年6月19日に日本製薬団体連合会の「医薬品の安全対策に関する講習会」が行われ、添付文書 新記載要領化の進捗状況のご説明がありました。
なんとまだ約25%しか新記載要領化されていないということでした。
タイムリミットの2024年3月末までの9ヶ月で残り約1万件、
一体この先どうなるんでしょう、なるようにしかならないのでしょうか・・・
大光印刷株式会社では、多くの医薬品メーカー様の添付文書データ制作をいただいております。
・新記載要領化(XML、PDF作成)
・通知日が決まっている改訂(旧記載SGML、新記載XML、PDF作成)
・自主改訂(旧記載SGML、新記載XML、PDF作成)
など日々多くの新規、改訂作業を進めております。
作業ミスや遅延によってご迷惑をおかけしないよう、細心の注意を払って作業をしております。
しかしながら、
通常の改訂作業 + 新記載要領化
が重なると、ご提出スケジュールを調整しながら、通知日が決まっている改訂品目の優先せざるを得ない状況となります。
そのため「新記載要領化」と「通常の改訂」をスムースに進めるために、
「新記載要領化」への対応でお願いがあります。
新記載要領化でのお願い
限られた期限の中でスムースに進めるため、以下のご協力をお願いいたします。
■修正回数の削減
■シンプルな修正指示
■PDFは自動組版(Pix Auto)
もしかしたら、弊社だけでなくデータ作成を受けられている同業社様も同じ思いかもしれません。 ご留意いただけますと幸いです。
修正回数の削減
できるかぎり初校~2校目で校了できるよう進めていただきたいです。
初回の指示(ご支給Word)で、追加修正無しの状態まで確認いただいてからの入稿だとありがたいです。
修正回数が多いメーカー様の場合、
4回以上修正することもあります
(ケースバイケースですが)。
今まで4回修正したところを、1回の修正で済めば、節約できた修正3回分のリソースを別の改訂にあてることができます。
つまり修正回数が減る分、お請けできる製品数も増やすことができます。
逆をいうと、修正回数が減らないままだと、弊社キャパシティも厳しいままとなってしまいます。
シンプルな修正指示
「誰が見ても修正内容がわかる指示」をお願い申し上げます。
いただいた修正指示(PDFやWordなど)について、弊社内で補足や追記をすることがあります。
しかし弊社内での補足や追記によって、作業開始遅れや作業ミスを招いてしまう可能性もあります。
シンプルな修正指示は難しいかもしれませんが、お互いのリスク軽減のため、ご協力お願いいたします。
もし弊社から修正指示の方法をご提案をした場合は、ご対応いただけますと幸いです。
電子添文PDFは自動組版(Pix Auto)

従来の添付文書(電子添文)PDFは、InDesignなどを使い、ほぼ手作業で作成しておりました。
少しでも見た目が整うように微調整を繰り返すこともありました。
しかし、残りの製品数を新記載化することを考慮すると、手作業でのPDF対応が難しい時期になっています。
そこで弊社では以前から提案しておりました、自社開発の自動組版システム Pix AutoでPDF作成します。
自動組版システム Pix Autoであれば、正確で、なおかつスピードアップができ、製薬メーカー様のお役に立つことができます。
XMLよりテキスト流用するため、ヒューマンエラーが無く、作成日数も削減できます。
ただし、文字品質とエラーリスク軽減のため、細かなレイアウト調整はできないこと、ご了承ください。
ジェネリック医薬品の新記載化 足し算、引き算について
2023年6月19日に開催された、日本製薬団体連合会(日薬連)安全性委員会主催「医薬品の安全対策に関する講習会」で、ジェネリック医薬品(GE品)の新記載化対応に関する話題がありました。
ジェネリック医薬品の新記載化進め方として「足し算と引き算」というキーワードがあがりました。
大光印刷株式会社では「足し算」での進め方をおすすめします。
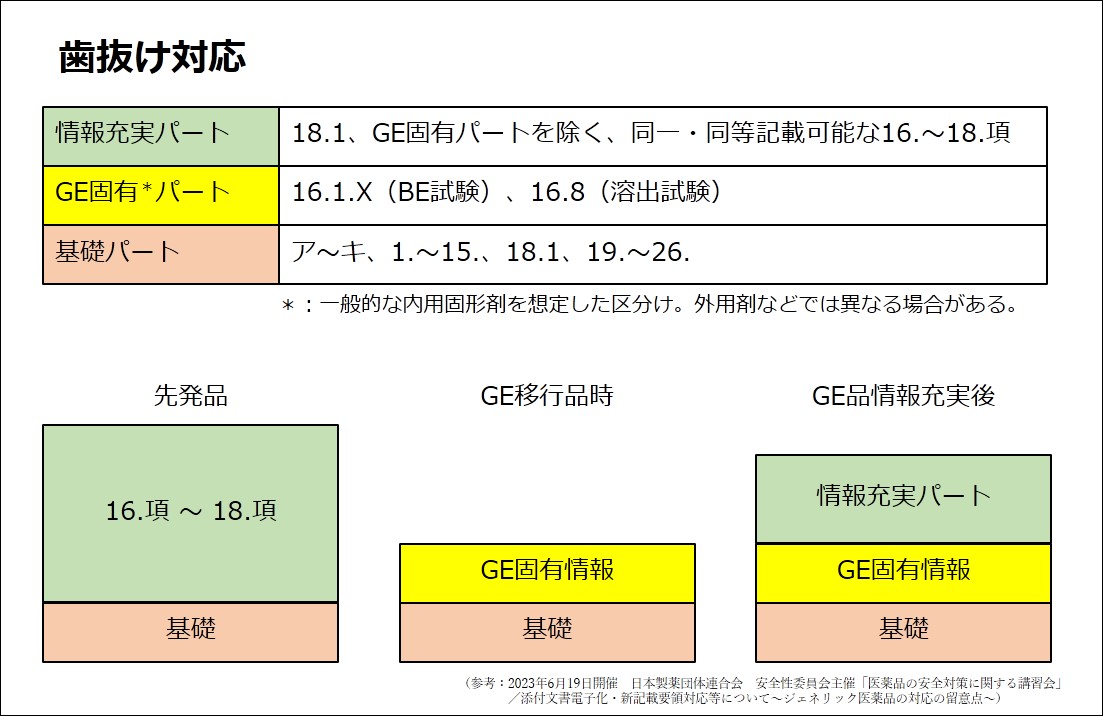
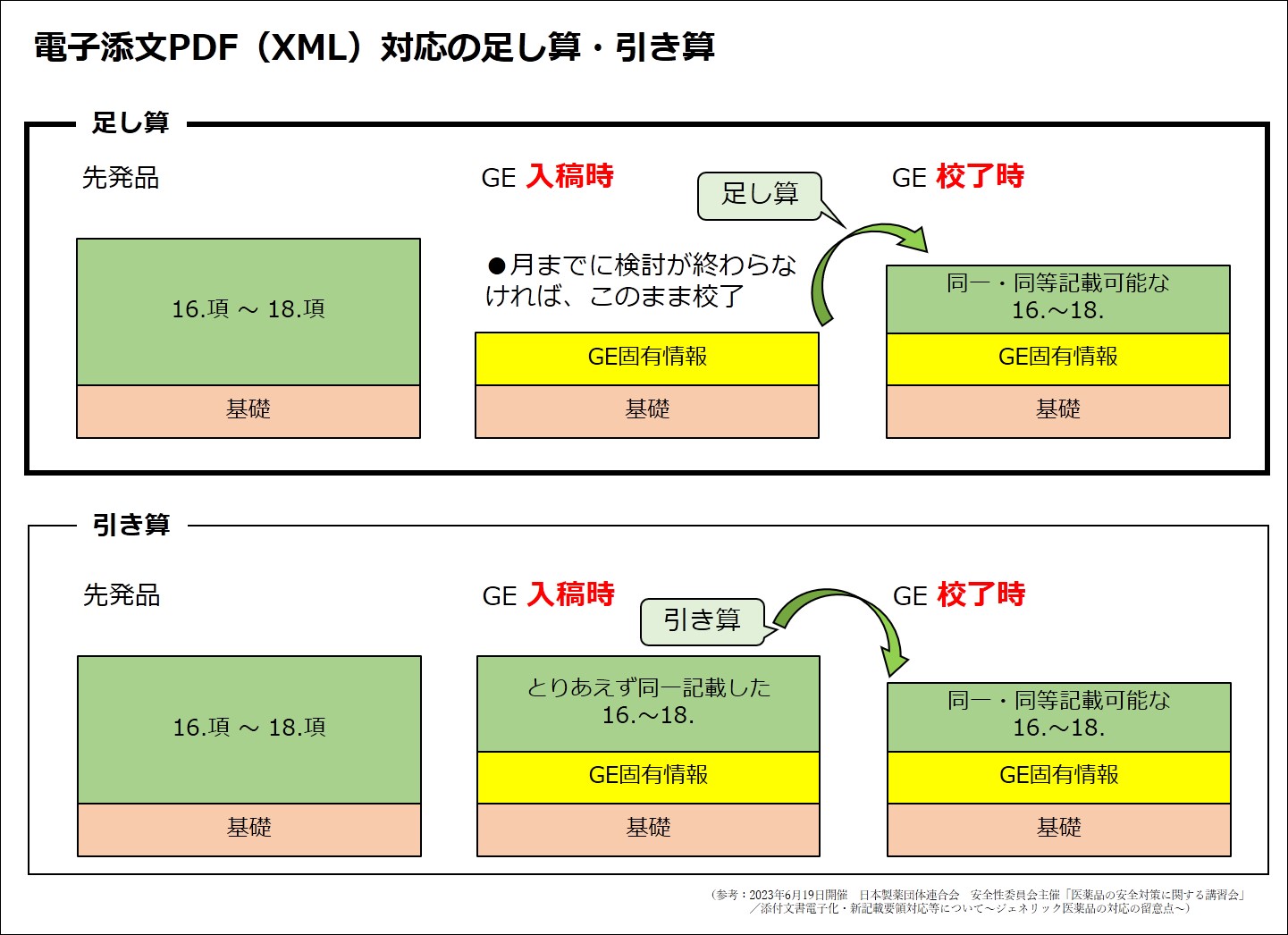
ジェネリック医薬品の新記載化 足し算方式での進め方
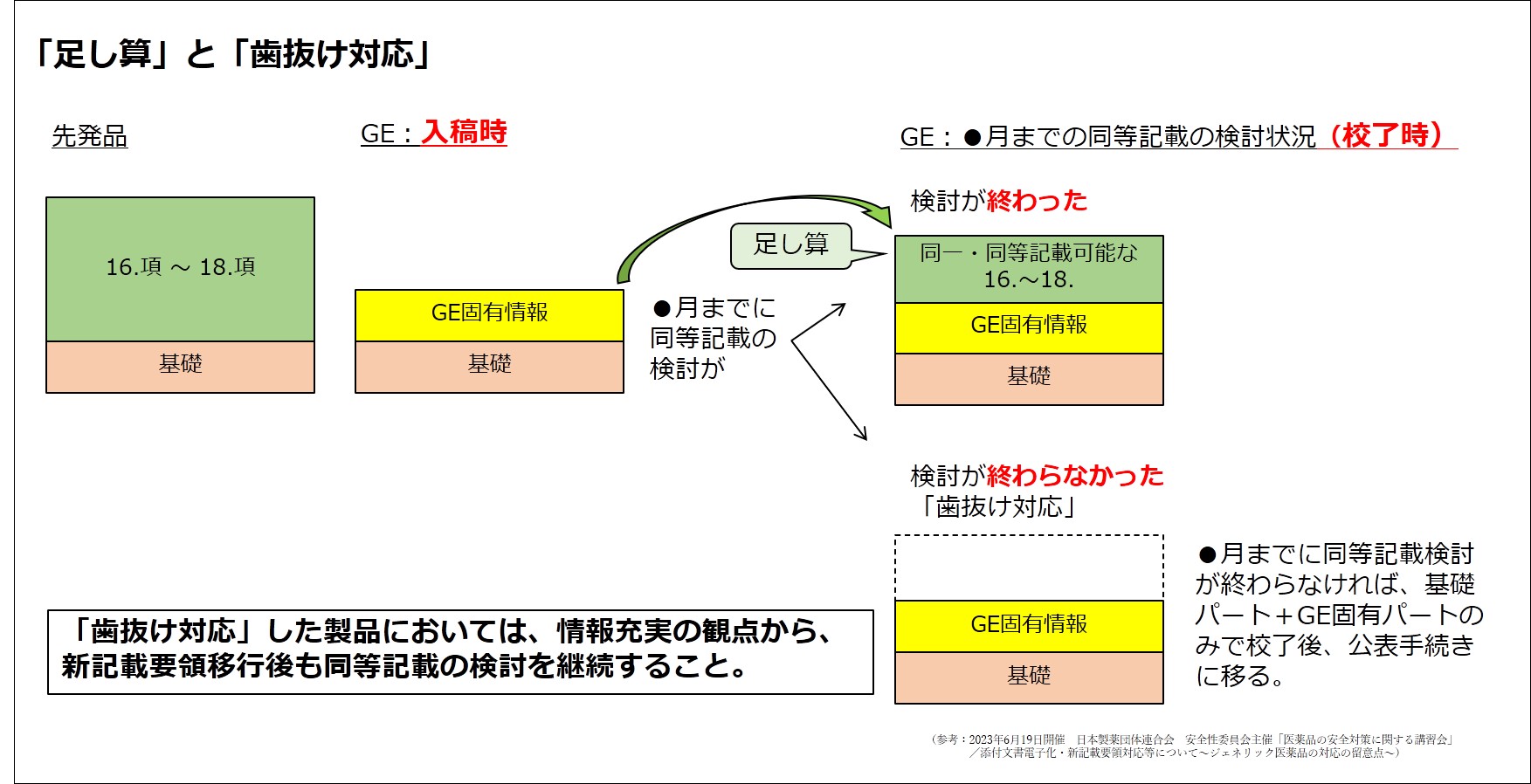
会社ごとにリミットを定める必要があるが、●月までに16~18項の同等記載検討が終われば、基礎パート+GE固有パートに情報充実パートを追加するよう取引業者へ依頼し、校了後、公表手続きに移る。
●月までに同等記載検討が終わらなければ、基礎パート+GE固有パートのみで校了後、公表手続きに移る。
「歯抜け対応」した製品においては、情報充実の観点から、新記載要領移行後も同等記載の検討を継続すること。
今後、同等記載事例の蓄積により考え方が整理される。整理された考え方に基づき、16~18項の記載内容を充実させていくこと。
(参考:2023年6月19日開催 日本製薬団体連合会(日薬連)安全性委員会主催「医薬品の安全対策に関する講習会」/添付文書電子化・新記載要領対応等について~ジェネリック医薬品の対応の留意点~)
日頃から大変お世話になっている製薬業界の皆々様のため、
出来る限りの対応をさせていただきますので、
今後も是非ともよろしくお願いいたします。











